El Baño María

Muchos de nosotros hemos preparado (O al menos intentado) algún tipo de flan, pudin, o simplemente fundido chocolate.
Para poder cocinar este tipo de alimentos tenemos que ser muy cuidadosos. Si ponemos poca potencia no comienza la cocción, pero si aumentamos demasiado la potencia o no removemos correctamente; se quema.
Es por ello que para realizar este tipo de elaboraciones se emplea un método denominado El Baño María, mediante el cual podemos fundir por ejemplo chocolate sin ningún peligro y nos aseguramos de que no se quemará.
Cómo se realiza el Baño María
Para ello necesitaremos 2 recipientes, uno más grande que otro, y agua.
El procedimiento es el siguiente:
- Colocamos el recipiente de mayor tamaño encima de nuestro fogón o fuente de calor.
- Llenamos de agua dicho recipiente.
- Colocamos flotando (O evitando que toque el fondo) nuestro recipiente pequeño dentro del grande con agua.
- Añadimos lo que queramos cocinar dentro del recipiente pequeño y comenzamos a calentar el agua
De esta manera, el agua comienza a calentarse hasta entrar en ebullición. Indirectamente, por pura convección, nuestro recipiente más pequeño, que se encuentra sumergido en el agua, se calentará lentamente y sin superar una determinada temperatura, lo que garantiza una cocción adecuada.
Por qué sucede y por qué es útil el Baño María
Este método no solo se emplea en la cocina. También se emplea en la industria farmacéutica, para fabricar cosméticos o en la industria química en general. Además se pueden emplear otros líquidos en vez de agua.
Punto de ebullición
El punto de ebullición de una sustancia es la temperatura, a presión atmosférica (Nivel del mar), a la cual dicha sustancia comienza a cambiar su fase de líquida a gas o viceversa. Depende estrechamente de la presión, siendo mayor cuanto mayor es la presión y menor a medida que la presión disminuye. Esto se debe a que, a menor presión, hay “menos moléculas de aire” rodeando al fluido. De esta forma las moléculas del líquido pueden escapar con mayor facilidad al “haber más hueco”.
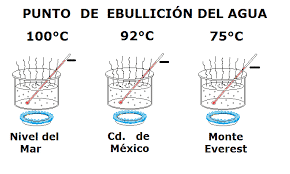
La temperatura es una magnitud referida al calor o energía de una sustancia. Pero, realmente este concepto no es tan simple.
El calor de una sustancia hace referencia al promedio de la energía cinética de las partículas que la componen, estando asociada a pequeñas rotaciones y vibraciones.
Las moléculas de un fluido (Líquidos y gases) contenido en un recipiente se encuentran sometidas a diferentes fuerzas como la presión del exterior y la tensión superficial. Son estas fuerzas las que hacen que las moléculas de un fluido se encuentren concentradas en la fase líquida.
Cuando aumentamos la temperatura, la energía cinética aumenta, hasta el punto que las partículas son capaces de romper dicha tensión para así escapar en forma de gas. Dicha temperatura es la que marca la temperatura de ebullición a una presión dada.
Calentando un líquido más de la cuenta
Imaginad un cazo lleno de agua que estamos calentando. Comienzan a aparecer las primeras burbujas y el agua entra en ebullición.
Con el cazo aún en el fuego, duplicamos la potencia y el agua comienza a hervir con mucha más fuerza. ¿A qué temperatura se encuentra el agua?
Sin usar ningún termómetro: a 100 grados. El agua líquida a presión atmosférica jamás superará los 100 grados. Pero, ¿Cómo es posible? ¡Si estoy añadiendo más calor!
Como he explicado anteriormente, la temperatura es una medida de la energía cinética de las moléculas.
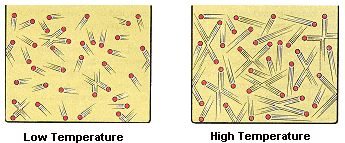
Cuando una sustancia alcanza su punto de ebullición quiere decir que sus moléculas ya están listas para romper los enlaces y escapar. En este caso, necesitan un empujón extra de energía o, más bien calor, denominado calor latente. A partir de este punto toda la energía que la sustancia reciba no la empleará para aumentar la energía cinética de sus moléculas (Lo que aumentaría la temperatura), sino en romper los enlaces y escapar. Durante un cambio de fase la temperatura siempre permanece constante.
Con el cambio de sólido a líquido (Fusión) pasa lo mismo. Vamos a tomar como ejemplo el hielo.
No podemos encontrar agua líquida a menos de 0ºC ni hielo a más de 0ºC, siempre que estemos en condiciones normales. Si en vez de agua “pura” tenemos agua salada, la cosa cambia. En este caso, ¡El punto de fusión puede bajar hasta los -20ºC!
Es por ello que cuando nieva se le echa sal a las carreteras, de forma que la nieve se funde. Del mismo modo si queremos hacer helado por ejemplo sin usar un congelador deberemos de empelar agua con sal. De esta forma, el agua en estado líquido se encontrará por debajo de los 0ºC y podrá absorber calor de forma uniforme y más fácilmente que en estado sólido (Si empleásemos hielo la superficie de contacto no sería continua y no enfriaría correctamente).

Qué ocurre con el agua al hacer El Baño María
Cuando empleamos este método, el recipiente intermedio contiene agua en ebullición a 100ºC. Siguiendo la teoría expuesta arriba podemos asegurar que el agua no superará dicha temperatura.
Es por ello que se emplea esta propiedad para emplear un recipiente más pequeño que se coloca dentro del agua, de manera que, sea cual sea la potencia que le pongamos al fuego, sabemos que no vamos a superar los 100ºC y que además la temperatura será constante.
Esto es útil como hemos introducido al principio para fundir chocolate por ejemplo. El punto de fusión del chocolate se encuentra alrededor de los 50ºC. Y empleando el Baño María repartimos el calor uniformemente y con un tope, los 100ºC. Esto evitará que se nos queme el chocolate.
Porque… ¿A que nunca se te ha quemado comida en agua hirviendo?
Sin embargo, empleando aceite si. El punto de ebullición del aceite se encuentra en torno a los 200ºC, y a esa temperatura se quema la comida. Ocurre en una freidora, pero más rápidamente en una sartén al encontrarse en contacto con el metal.

Para finalizar este artículo doy un consejo: Cuando estemos cociendo pasta o cualquier cosa y el agua comience a hervir deberíamos de bajar el fuego al mínimo necesario. Para gastar la menor electricidad posible y cocer algo correctamente con que el agua hierva es suficiente, ya que sabemos que se encontrará a 100ºC y el alimento se estará cociendo. Aumentar la potencia haciendo que el agua hierva más agresivamente únicamente hará que se nos evapore el agua del recipiente y gastemos más electricidad.



3 comentarios en «La ciencia detrás del Baño María»